기대감이 좌절로, 그룹 시총 11조 증발
상장사 8곳 일제히 하한가, 3월 최고점 대비 시총 절반 감소
리보세라닙 미국 FDA 허가 실패로 HLB 그룹 코스피·코스닥 상장사 8곳의 시가총액이 11조원 가까이 증발했다. 허가 기대감으로 한때 22조원에 달했던 시총은 17일 하한가를 맞으며 12조원 아래로 떨어졌다.
이번 사태가 업계에 미친 파장도 만만찮다. 코스닥 제약바이오 섹터가 5% 이상 하락하는 등 타 섹터보다 부진한 흐름을 보였다. 업계는 이번 악재가 얼마나 오래 지속될지 촉각을 곤두세우고 있다.
◇22조원 돌파했던 HLB그룹 시총, 한순간에 12조원 아래로 '뚝'
HLB가 미국 식품의약국(FDA)으로부터 리보세라닙·캄렐리주맙에 대한 보안요구서한(CRL)을 받았다고 공표한 17일 오전. 장 시작과 함께 HLB그룹 상장사 8곳이 일제히 하한가를 맞았다.
HLB그룹사 중 HLB글로벌은 코스피, HLB, HLB생명과학, HLB제약, HLB테라퓨틱스, HLB이노베이션, HLB바이오스텝, HLB파나진 7개사는 코스닥에 상장돼 있다. 시총 규모로는 HLB가 가장 몸집이 크다.
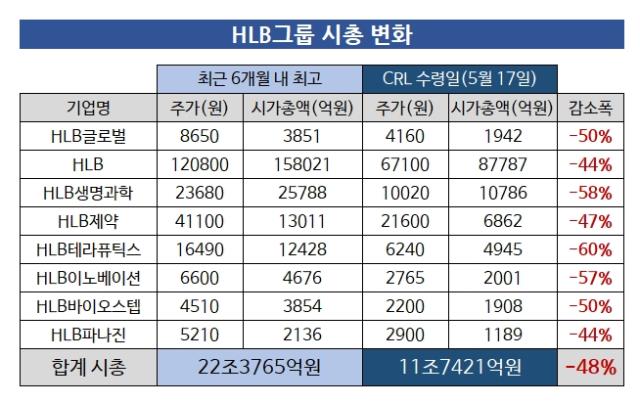
하한가를 맞은 8곳의 시가총액을 집계한 결과 11조7421억원으로 나타났다. 올해 리보세라닙 미국 허가 기대감으로 최대 22조3765억원까지 올랐던 것과 비교하면 반토박이 난 것이다. 기대감이 좌절로 바뀌며 약 11조원이 증발했다.
HLB그룹 주가는 올해 들어서며 꾸준히 상승 흐름을 보였다. 주가가 최고점에 달한 시기는 3월이다. 모체인 HLB를 필두로 일제히 신고가를 찍었다. HLB가 리보세라닙 허가에 자신감을 피력하면서 상승세를 이끌었다.
당시 HLB의 시가총액은 15조원을 돌파했다. 연초 코스닥 시총 5위에서 2위까지 올라섰다. 코스닥 상장 바이오·헬스케어 기업 상위 20개 목록에만 HLB그룹 기업 4곳이 이름을 올렸다. HLB생명과학, HLB제약, HLB테라퓨틱스가 모두 시총 1조원을 넘기면서다. HLB생명과학 2조5788억원, HLB제약 1조3011억원, HLB테라퓨틱스 1조2428억원을 각각 기록했다.
이들 중 현재 시총 1조원을 넘긴 곳은 HLB와 HLB생명과학 단 두 곳이다. 최고점 대비 시총이 절반 가까이 사라지면서 HLB는 8조7787억원으로 쪼그라들었다. HLB생명과학은 1조786억원으로 1조원 턱걸이에 놓였다.
이 외에도 HLB그룹 상장사들의 현 시가총액은 지난 3월 최고점 대비 최대 60% 쪼그라든 상태다. HLB테라퓨틱스가 4945억원으로 60% 빠졌고 HLB이노베이션은 57% 감소했다. HLB글로벌(-50%), HLB제약(-47%), HLB바이오스텝(-50%), HLB파나진(-44%) 역시 절반가량의 감소를 기록했다.
제약업계 관계자는 "FDA와 미팅을 진행하다보면 CRL을 수령할 수 있겠다는 예측을 할 수 있다"면서도 "회사 입장에서는 마지막 순간까지 결과를 예단하기 어려우니 사전에 시장에 입장을 내놓기 어려웠을 것"이라고 말했다.
◇HLB 사태로 제약바이오 섹터 부진…5년 전 악몽 재현되나
리보세라닙 CRL 수령은 제약바이오 섹터 전반에도 악영향을 미쳤다. 바이오USA, ASCO 등 굵직한 학회와 박람회를 앞두고 훈풍을 기대했던 업계에 찬물이 끼얹어졌다.
이날 코스닥 제약바이오 섹터는 7% 가까이 하락하며 코스닥 섹터 중 가장 큰 폭으로 떨어졌다. 코스닥 지수 하락폭인 1.5%를 크게 상회하는 수준이다.
문제는 이번 악재가 하루이틀 새 수습될 것으로 보이지 않는다는 점이다. HLB는 2019년에도 리보세라닙으로 주가에 큰 타격을 받은 적 있다. HLB가 진행하던 리보세라닙 위암 글로벌 3상이 목표점을 달성하지 못했던 것이 시발점이 됐다. 발표가 난 날부터 2거래일 연속 하한가를 맞았다.
부진한 주가 흐름은 한동안 계속됐다. 발표 직전 5만원대였던 주가는 연속 하한가로 3만원대로 급락했고 7월 말 3만원선이 무너졌다. 8월 중순에서야 반등 조짐을 보였다.
업계는 이번 사태의 파장이 얼마나 오래 지속될지 촉각을 곤두세우고 있다. HLB는 진양곤 회장이 직접 나서 사태를 수습 중이다.
물론 FDA가 CRL을 발송하는 사례는 비일비재하고 지적사항을 보완해 허가를 받는 사례도 허다하다. 따라서 CRL 수령 자체보다는 지적받은 부분이 빠르게 보완가능한 문제인지, 개발전략을 전면 수정해야 할 심각한 문제인지 구체적인 내용을 파악할 필요가 있다.
진 회장은 공식 SNS 채널을 통해 "리보세라닙에 대해선 보완 요구를 받지 않았으며 병용 약제인 캄렐리주맙 제조공정(CMC)과 관련해 마이너한 지적이 있었다"고 해명했다.
이번 사태가 업계에 미친 파장도 만만찮다. 코스닥 제약바이오 섹터가 5% 이상 하락하는 등 타 섹터보다 부진한 흐름을 보였다. 업계는 이번 악재가 얼마나 오래 지속될지 촉각을 곤두세우고 있다.
◇22조원 돌파했던 HLB그룹 시총, 한순간에 12조원 아래로 '뚝'
HLB가 미국 식품의약국(FDA)으로부터 리보세라닙·캄렐리주맙에 대한 보안요구서한(CRL)을 받았다고 공표한 17일 오전. 장 시작과 함께 HLB그룹 상장사 8곳이 일제히 하한가를 맞았다.
HLB그룹사 중 HLB글로벌은 코스피, HLB, HLB생명과학, HLB제약, HLB테라퓨틱스, HLB이노베이션, HLB바이오스텝, HLB파나진 7개사는 코스닥에 상장돼 있다. 시총 규모로는 HLB가 가장 몸집이 크다.
하한가를 맞은 8곳의 시가총액을 집계한 결과 11조7421억원으로 나타났다. 올해 리보세라닙 미국 허가 기대감으로 최대 22조3765억원까지 올랐던 것과 비교하면 반토박이 난 것이다. 기대감이 좌절로 바뀌며 약 11조원이 증발했다.

HLB그룹 주가는 올해 들어서며 꾸준히 상승 흐름을 보였다. 주가가 최고점에 달한 시기는 3월이다. 모체인 HLB를 필두로 일제히 신고가를 찍었다. HLB가 리보세라닙 허가에 자신감을 피력하면서 상승세를 이끌었다.
당시 HLB의 시가총액은 15조원을 돌파했다. 연초 코스닥 시총 5위에서 2위까지 올라섰다. 코스닥 상장 바이오·헬스케어 기업 상위 20개 목록에만 HLB그룹 기업 4곳이 이름을 올렸다. HLB생명과학, HLB제약, HLB테라퓨틱스가 모두 시총 1조원을 넘기면서다. HLB생명과학 2조5788억원, HLB제약 1조3011억원, HLB테라퓨틱스 1조2428억원을 각각 기록했다.
이들 중 현재 시총 1조원을 넘긴 곳은 HLB와 HLB생명과학 단 두 곳이다. 최고점 대비 시총이 절반 가까이 사라지면서 HLB는 8조7787억원으로 쪼그라들었다. HLB생명과학은 1조786억원으로 1조원 턱걸이에 놓였다.
이 외에도 HLB그룹 상장사들의 현 시가총액은 지난 3월 최고점 대비 최대 60% 쪼그라든 상태다. HLB테라퓨틱스가 4945억원으로 60% 빠졌고 HLB이노베이션은 57% 감소했다. HLB글로벌(-50%), HLB제약(-47%), HLB바이오스텝(-50%), HLB파나진(-44%) 역시 절반가량의 감소를 기록했다.
제약업계 관계자는 "FDA와 미팅을 진행하다보면 CRL을 수령할 수 있겠다는 예측을 할 수 있다"면서도 "회사 입장에서는 마지막 순간까지 결과를 예단하기 어려우니 사전에 시장에 입장을 내놓기 어려웠을 것"이라고 말했다.
◇HLB 사태로 제약바이오 섹터 부진…5년 전 악몽 재현되나
리보세라닙 CRL 수령은 제약바이오 섹터 전반에도 악영향을 미쳤다. 바이오USA, ASCO 등 굵직한 학회와 박람회를 앞두고 훈풍을 기대했던 업계에 찬물이 끼얹어졌다.
이날 코스닥 제약바이오 섹터는 7% 가까이 하락하며 코스닥 섹터 중 가장 큰 폭으로 떨어졌다. 코스닥 지수 하락폭인 1.5%를 크게 상회하는 수준이다.
문제는 이번 악재가 하루이틀 새 수습될 것으로 보이지 않는다는 점이다. HLB는 2019년에도 리보세라닙으로 주가에 큰 타격을 받은 적 있다. HLB가 진행하던 리보세라닙 위암 글로벌 3상이 목표점을 달성하지 못했던 것이 시발점이 됐다. 발표가 난 날부터 2거래일 연속 하한가를 맞았다.
부진한 주가 흐름은 한동안 계속됐다. 발표 직전 5만원대였던 주가는 연속 하한가로 3만원대로 급락했고 7월 말 3만원선이 무너졌다. 8월 중순에서야 반등 조짐을 보였다.
업계는 이번 사태의 파장이 얼마나 오래 지속될지 촉각을 곤두세우고 있다. HLB는 진양곤 회장이 직접 나서 사태를 수습 중이다.
물론 FDA가 CRL을 발송하는 사례는 비일비재하고 지적사항을 보완해 허가를 받는 사례도 허다하다. 따라서 CRL 수령 자체보다는 지적받은 부분이 빠르게 보완가능한 문제인지, 개발전략을 전면 수정해야 할 심각한 문제인지 구체적인 내용을 파악할 필요가 있다.
진 회장은 공식 SNS 채널을 통해 "리보세라닙에 대해선 보완 요구를 받지 않았으며 병용 약제인 캄렐리주맙 제조공정(CMC)과 관련해 마이너한 지적이 있었다"고 해명했다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >

