브릿지바이오, 남은현금 464억…CRO 의존도 낮춰 비용절감
임상 진입 파이프라인 4건, 작년 R&D비용 311억원...현금성자산 464억원
브릿지바이오테라퓨틱스가 신약개발 임상에 속도를 내고 있다. 올해 폐암 파이프라인이 추가로 임상에 진입하며 R&D 비용은 상당 부분 늘어날 것으로 전망된다.
회사 측은 정부과제와 자체 임상 조직을 강화해 임상시험수탁기관(CRO) 비용을 줄인다는 계획이다.
◇작년 R&D 비용 311억원으로 매년 증가추세...현금성 자산은 464억원
브릿지바이오테라퓨틱스(이하 브릿지바이오)는 작년에만 연구개발비로 311억원을 투입하며 신약 임상 개발에 속도를 내고 있다. 작년 R&D 비용 대비 76% 증가하며 회사는 신약 임상에 총력을 기울이는 모습이다. 작년 현금성자산은 464억원이다. 작년에 유상증자로 현금성자산은 소폭 증가했지만 2019년 현금성자산 631억원 대비 약 26% 감소한 규모다.
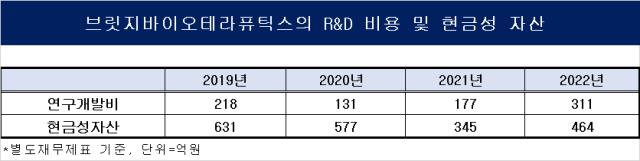
현재 보유한 파이프라인 4건 임상 진행은 가능하지만 향후 파이프라인 확장과 후기 임상 진입을 위한 자금 여력은 충분치 않은 상황이다. 통상적으로 신약 임상 1/2상을 하기 위해서 50~100억원 가량의 비용이 소요된다. 브릿지바이오가 초기 신약 후보물질을 도입해 개발(Development)에 집중하는 회사인 만큼 임상 비용을 더욱 늘어날 전망이다.
특히 임상에 집중하는 회사인 만큼 위탁용역비는 매년 증가하고 있다. 작년 위탁용역비는 271억원을 기록하며 2020년 104억원 대비 두배 이상 늘었다. 이는 매년 CRO 비용 등이 늘었기 때문이다. 이러한 상황에 대비하기 위해 회사는 CRO 의존도를 낮추고 자체 임상 역량을 강화한다는 전략이다.
구체적으로 프로젝트 관리에만 무게를 뒀던 기존 체제에서 임상시험설계, 통계, 약물감시 등 업무 내재화를 시작했다. 이어 올해는 국내와 미국에서 진행하는 임상 운용을 직접 수행하면서 효율성을 높인다는 전략이다.
브릿지바이오 관계자는 "DIBO (Do It By Ourselves) 모델을 통해 자체 임상 조직을 강화해서 CRO 의존도를 낮춰 임상 비용을 더욱 효과적으로 집행해 나갈 예정"이라고 덧붙였다.
◇BBT-207, 임상 1/2상 승인되며 임상 파이프라인 4건으로 확대
브릿지바이오는 올해 4월 비소세포폐암 파이프라인 'BBT-207'의 미국 임상 1/2상 승인을 받으며 임상 파이프라인만 4개를 운영 중이다. 해당 임상은 미국과 국내에서 약 15개 임상기관에서 비소세포폐암 환자 최대 92명을 대상으로 진행된다. 임상을 통해 약물의 안전성, 내약성 및 항종양 효능을 확인한다.
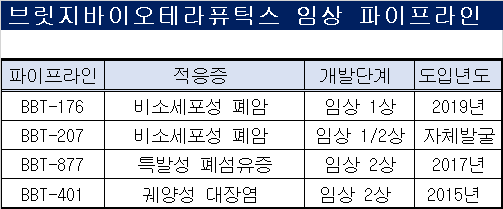
2019년 베링거인겔하임에 기술이전됐다가 독성 이슈로 반환을 받은 BBT-877은 미국 식품의약국(FDA)으로부터 임상 2상을 승인받았다. 올해 호주에서 임상 2상 첫 환자 투약이 개시됐다. 이 외에도 BBT-176(비소세포폐암), BBT-401(궤양성대장염) 등을 대상으로 임상을 진행 중이다.
임상 파이프라인만 4건에 달하는 만큼 현금의 축소는 브릿지바이오에 상당한 부담이 된다. 특히 임상 대부분이 글로벌 임상이 진행되고 있어 비용 부담은 상당할 것으로 보인다.
브릿지바이오는 현재 보유하고 있는 현금으로 올해 임상을 차질없이 진행한다는 방침이다. 추가조달에 나설 계획은 현재로선 고려하고 있지 않다. 앞서 브릿지바이오는 임상 자금 조달을 목적으로 작년 5월 제3자배정 유상증자 방식으로 약 486억원의 자금을 유치했다.
회사 관계자는 "현 단계에서는 임상 과제 개발에 차질이 없는 수준으로 자금이 집행되고 있다"며 "기술이전 추진과 더불어 추가적인 정부 지원 과제 수행 등을 통해서 임상 개발 비용을 더욱 효율적으로 집행해 나갈 계획"이라고 말했다.
회사 측은 정부과제와 자체 임상 조직을 강화해 임상시험수탁기관(CRO) 비용을 줄인다는 계획이다.
◇작년 R&D 비용 311억원으로 매년 증가추세...현금성 자산은 464억원
브릿지바이오테라퓨틱스(이하 브릿지바이오)는 작년에만 연구개발비로 311억원을 투입하며 신약 임상 개발에 속도를 내고 있다. 작년 R&D 비용 대비 76% 증가하며 회사는 신약 임상에 총력을 기울이는 모습이다. 작년 현금성자산은 464억원이다. 작년에 유상증자로 현금성자산은 소폭 증가했지만 2019년 현금성자산 631억원 대비 약 26% 감소한 규모다.

현재 보유한 파이프라인 4건 임상 진행은 가능하지만 향후 파이프라인 확장과 후기 임상 진입을 위한 자금 여력은 충분치 않은 상황이다. 통상적으로 신약 임상 1/2상을 하기 위해서 50~100억원 가량의 비용이 소요된다. 브릿지바이오가 초기 신약 후보물질을 도입해 개발(Development)에 집중하는 회사인 만큼 임상 비용을 더욱 늘어날 전망이다.
특히 임상에 집중하는 회사인 만큼 위탁용역비는 매년 증가하고 있다. 작년 위탁용역비는 271억원을 기록하며 2020년 104억원 대비 두배 이상 늘었다. 이는 매년 CRO 비용 등이 늘었기 때문이다. 이러한 상황에 대비하기 위해 회사는 CRO 의존도를 낮추고 자체 임상 역량을 강화한다는 전략이다.
구체적으로 프로젝트 관리에만 무게를 뒀던 기존 체제에서 임상시험설계, 통계, 약물감시 등 업무 내재화를 시작했다. 이어 올해는 국내와 미국에서 진행하는 임상 운용을 직접 수행하면서 효율성을 높인다는 전략이다.
브릿지바이오 관계자는 "DIBO (Do It By Ourselves) 모델을 통해 자체 임상 조직을 강화해서 CRO 의존도를 낮춰 임상 비용을 더욱 효과적으로 집행해 나갈 예정"이라고 덧붙였다.
◇BBT-207, 임상 1/2상 승인되며 임상 파이프라인 4건으로 확대
브릿지바이오는 올해 4월 비소세포폐암 파이프라인 'BBT-207'의 미국 임상 1/2상 승인을 받으며 임상 파이프라인만 4개를 운영 중이다. 해당 임상은 미국과 국내에서 약 15개 임상기관에서 비소세포폐암 환자 최대 92명을 대상으로 진행된다. 임상을 통해 약물의 안전성, 내약성 및 항종양 효능을 확인한다.

2019년 베링거인겔하임에 기술이전됐다가 독성 이슈로 반환을 받은 BBT-877은 미국 식품의약국(FDA)으로부터 임상 2상을 승인받았다. 올해 호주에서 임상 2상 첫 환자 투약이 개시됐다. 이 외에도 BBT-176(비소세포폐암), BBT-401(궤양성대장염) 등을 대상으로 임상을 진행 중이다.
임상 파이프라인만 4건에 달하는 만큼 현금의 축소는 브릿지바이오에 상당한 부담이 된다. 특히 임상 대부분이 글로벌 임상이 진행되고 있어 비용 부담은 상당할 것으로 보인다.
브릿지바이오는 현재 보유하고 있는 현금으로 올해 임상을 차질없이 진행한다는 방침이다. 추가조달에 나설 계획은 현재로선 고려하고 있지 않다. 앞서 브릿지바이오는 임상 자금 조달을 목적으로 작년 5월 제3자배정 유상증자 방식으로 약 486억원의 자금을 유치했다.
회사 관계자는 "현 단계에서는 임상 과제 개발에 차질이 없는 수준으로 자금이 집행되고 있다"며 "기술이전 추진과 더불어 추가적인 정부 지원 과제 수행 등을 통해서 임상 개발 비용을 더욱 효율적으로 집행해 나갈 계획"이라고 말했다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >



