프레스티지바이오파마, 허셉틴시밀러 'EMA 승인권고'
2022년 첫 도전 불발 2년 만, 국내 3번째 글로벌 바이오시밀러 플레이어 발돋움
프레스티지바이오파마가 허셉틴 바이오시밀러 '투즈뉴(Tuznue, 개발명 HD201)'의 상업화 가능성이 열렸다. 유럽의약품청(EMA)으로부터 승인 권고’(Positive opinion)'를 받으면서다. 2022년 품목허가를 자진 철회한 지 약 2년 간의 재도전 끝에 결실이다.
국내 기준 셀트리온과 삼성바이오에피스에 이어 3번째로 글로벌 문턱을 넘게 된다. 글로벌 바이오시밀러 시장에선 33번째다. '항체 바이오시밀러'로 범위를 좁히면 21번째 제품 출시 주자다. 그룹이 추진하는 '엔드 투 엔드' 사업 전략에도 청신호가 켜졌다.
◇2022년 자진철회 후 2년만의 결실, '국내 3번, 글로벌 21번 주자'
프레스티지바이오파마는 26일(현지시간) EMA 산하 약물사용자문위원회(CHMP)로부터 투즈뉴에 대한 유럽지역 승인권고를 받았다. 투즈뉴는 사람 표피성장인자수용체 2(HER2) 양성인 유방암 환자와 전이성 위암 치료에 사용하는 허셉틴(성분명 트라스투주맙)의 바이오시밀러다.
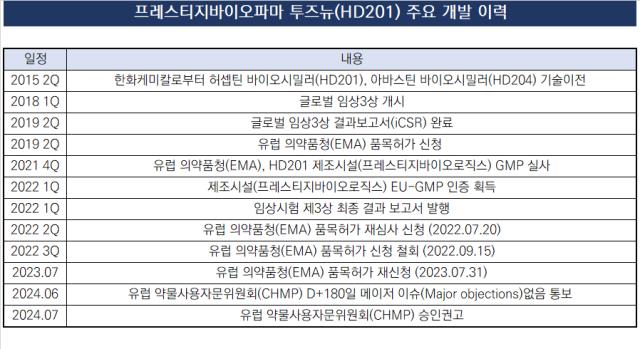
CHMP의 판매 승인 권고에 따라 투즈뉴는 오는 10월부터 유럽연합집행위원회(EC)의 허가를 받고 유럽 30개국에 진출할 수 있게 됐다. 블록버스터 항암제인 허셉틴은 2014년 유럽 2019년엔 미국에서 특허가 만료됐다. 이후 오리지널과 바이오시밀러를 포함해 연간 5조5000억원의 관련 시장을 형성하고 있다.
올해로 허셉틴 바이오시밀러 시장 개화 10년을 맞은 유럽 시장엔 오리지널인 허셉틴 외에 6개의 품목(암젠 칸진티, 화이자 트라지메라, 비아트리스 오기브리, 삼성바이오에피스 온투르잔트, 셀트리온 허주마 헨리우스 제르스팩)이 자리해 있다.
유럽 허셉틴 시장에선 일곱번째 후발 주자지만 기업 내에서 갖는 의미는 상당하다. 이번 승인 권고로 국내외를 포함해 프레스티지바이오파마의 마수걸이 상업화 성과 창출을 눈앞에 뒀다. HD201은 프레스티지바이오파마의 총 12개 파이프라인 가운데 개발 단계가 가장 앞서 있었는데 인허가에서 굴곡진 역사를 겪으며 상업화 타임라인이 밀렸다.
그럼에도 국내에서는 셀트리온, 삼성바이오에피스에 이은 세번째로 유럽 바이오시밀러 시장에 진출했다. 전 세계로 시야를 넓혀도 바이오시밀러로 유럽 시장의 벽을 넘은 회사는 32곳밖에 없었다. 이중 항체의약품 바이오시밀러로 허가를 받은 회사는 20곳이다.
박소연 프레스티지바이오파마 회장은 "투즈뉴의 유럽 허가 권고로 그룹의 첫번째 매출과 HD204 등 후속 파이프라인의 신속한 품목허가를 위한 트랙레코드가 쌓였다"며 "더불어 그룹 차원에서 글로벌 기준에 부합하는 바이오시밀러를 개발하고 생산하는 기업의 지위도 확보했다"고 말했다.
◇그룹사 손 잡고 시장에 합리적 가격 제시하는 후발주자 전략
비록 당초 계획 대비 상업화 일정이 밀렸지만 트라스투주맙 시장이 바이오시밀러에 힘입어 고속성장 중인 점은 눈길을 끈다. 2025년엔 약 6조원까지 성장할 전망이다. 전체 트라스투주맙 시장에서 유럽 지역이 차지하는 비중은 약 25%다. 합리적인 가격으로 양질의 바이오시밀러가 공급되자 시장이 덩달아 성장하는 구도가 만들어졌다.
바이오의약품 생산을 관계사 프레스티지바이오로직스가 맡게 되면서 그룹의 캐시인 전략도 본격적으로 가동이 가능해졌다. 프레스티지바이오로직스의 싱글유즈 기반 공정을 활용해 가격경쟁력 제고에 특화한 협력하는 사업구조를 꾸린다. 특히 유럽 바이오의약품 시장이 전반적인 약가 하방 압력을 받으며 급속도로 재편되는 점을 공략할 전망이다.
후발주자가 꺼내들 수 있는 가장 확실한 카드는 가격경쟁력 제고인데 마침 전반적인 가격 인하 러시가 이어지는 흐름에 올라탈 계획이다. 기계약된 파트너사들 및 신규 유럽 파트너사와 협의해 투즈뉴 초도 물량을 확정한 이후 즉각 생산에 돌입할 수 있도록 준비 작업을 시작했다.
일정 수준의 마일스톤도 획득하면서 2021년 상장 후 이어진 '매출 제로' 꼬리표도 단숨에 뗄 전망이다. 내부에서 전망하는 HD201 승인 권고 및 상업화에 따른 마일스톤 규모는 약 40억원이다.
프레스티지바이오파마 관계자는 "바이오시밀러 후발주자들이 시장 침투를 가속한 사례를 참고해 가격경쟁력 중심으로 상업화 전략을 추진하겠다"고 말했다.
국내 기준 셀트리온과 삼성바이오에피스에 이어 3번째로 글로벌 문턱을 넘게 된다. 글로벌 바이오시밀러 시장에선 33번째다. '항체 바이오시밀러'로 범위를 좁히면 21번째 제품 출시 주자다. 그룹이 추진하는 '엔드 투 엔드' 사업 전략에도 청신호가 켜졌다.
◇2022년 자진철회 후 2년만의 결실, '국내 3번, 글로벌 21번 주자'
프레스티지바이오파마는 26일(현지시간) EMA 산하 약물사용자문위원회(CHMP)로부터 투즈뉴에 대한 유럽지역 승인권고를 받았다. 투즈뉴는 사람 표피성장인자수용체 2(HER2) 양성인 유방암 환자와 전이성 위암 치료에 사용하는 허셉틴(성분명 트라스투주맙)의 바이오시밀러다.

CHMP의 판매 승인 권고에 따라 투즈뉴는 오는 10월부터 유럽연합집행위원회(EC)의 허가를 받고 유럽 30개국에 진출할 수 있게 됐다. 블록버스터 항암제인 허셉틴은 2014년 유럽 2019년엔 미국에서 특허가 만료됐다. 이후 오리지널과 바이오시밀러를 포함해 연간 5조5000억원의 관련 시장을 형성하고 있다.
올해로 허셉틴 바이오시밀러 시장 개화 10년을 맞은 유럽 시장엔 오리지널인 허셉틴 외에 6개의 품목(암젠 칸진티, 화이자 트라지메라, 비아트리스 오기브리, 삼성바이오에피스 온투르잔트, 셀트리온 허주마 헨리우스 제르스팩)이 자리해 있다.
유럽 허셉틴 시장에선 일곱번째 후발 주자지만 기업 내에서 갖는 의미는 상당하다. 이번 승인 권고로 국내외를 포함해 프레스티지바이오파마의 마수걸이 상업화 성과 창출을 눈앞에 뒀다. HD201은 프레스티지바이오파마의 총 12개 파이프라인 가운데 개발 단계가 가장 앞서 있었는데 인허가에서 굴곡진 역사를 겪으며 상업화 타임라인이 밀렸다.
그럼에도 국내에서는 셀트리온, 삼성바이오에피스에 이은 세번째로 유럽 바이오시밀러 시장에 진출했다. 전 세계로 시야를 넓혀도 바이오시밀러로 유럽 시장의 벽을 넘은 회사는 32곳밖에 없었다. 이중 항체의약품 바이오시밀러로 허가를 받은 회사는 20곳이다.
박소연 프레스티지바이오파마 회장은 "투즈뉴의 유럽 허가 권고로 그룹의 첫번째 매출과 HD204 등 후속 파이프라인의 신속한 품목허가를 위한 트랙레코드가 쌓였다"며 "더불어 그룹 차원에서 글로벌 기준에 부합하는 바이오시밀러를 개발하고 생산하는 기업의 지위도 확보했다"고 말했다.
◇그룹사 손 잡고 시장에 합리적 가격 제시하는 후발주자 전략
비록 당초 계획 대비 상업화 일정이 밀렸지만 트라스투주맙 시장이 바이오시밀러에 힘입어 고속성장 중인 점은 눈길을 끈다. 2025년엔 약 6조원까지 성장할 전망이다. 전체 트라스투주맙 시장에서 유럽 지역이 차지하는 비중은 약 25%다. 합리적인 가격으로 양질의 바이오시밀러가 공급되자 시장이 덩달아 성장하는 구도가 만들어졌다.
바이오의약품 생산을 관계사 프레스티지바이오로직스가 맡게 되면서 그룹의 캐시인 전략도 본격적으로 가동이 가능해졌다. 프레스티지바이오로직스의 싱글유즈 기반 공정을 활용해 가격경쟁력 제고에 특화한 협력하는 사업구조를 꾸린다. 특히 유럽 바이오의약품 시장이 전반적인 약가 하방 압력을 받으며 급속도로 재편되는 점을 공략할 전망이다.
후발주자가 꺼내들 수 있는 가장 확실한 카드는 가격경쟁력 제고인데 마침 전반적인 가격 인하 러시가 이어지는 흐름에 올라탈 계획이다. 기계약된 파트너사들 및 신규 유럽 파트너사와 협의해 투즈뉴 초도 물량을 확정한 이후 즉각 생산에 돌입할 수 있도록 준비 작업을 시작했다.
일정 수준의 마일스톤도 획득하면서 2021년 상장 후 이어진 '매출 제로' 꼬리표도 단숨에 뗄 전망이다. 내부에서 전망하는 HD201 승인 권고 및 상업화에 따른 마일스톤 규모는 약 40억원이다.
프레스티지바이오파마 관계자는 "바이오시밀러 후발주자들이 시장 침투를 가속한 사례를 참고해 가격경쟁력 중심으로 상업화 전략을 추진하겠다"고 말했다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >

